2016年5月17日,美国食品药品监督管理局加速批准纳武利尤单抗)用于治疗自体造血干细胞移植后复发或进展的经典霍奇金淋巴瘤(cHL)患者(HSCT) 和移植后 brentuximab vedotin (Adcetris)。
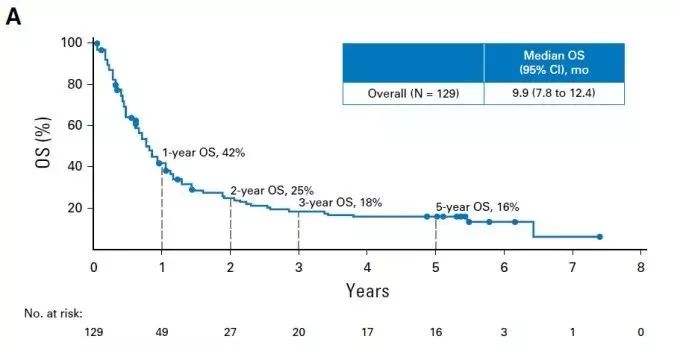
该批准基于两项单臂、多中心的 nivolumab 治疗成人复发性或难治性 cHL 试验。无论 Reed-Sternberg 细胞上的 PD-L1 表达状态如何,这些试验都招募了患者。主要疗效终点是由独立放射影像学审查委员会确定的客观缓解率(ORR)。其他结果测量包括反应持续时间(DOR)。
在先前接受自体 HSCT 和移植后 brentuximab vedotin 治疗的 95 名患者中评估了疗效。患者之前接受过中位数为 5 次的全身性治疗方案,并接受了中位数为 17 剂的纳武单抗。单药纳武利尤单抗产生 65% 的 ORR(95% CI:55%,75%),部分缓解率为 58%,完全缓解率为 7%。中位反应时间(Time-to-response)为 2.1 个月(范围:0.7 至 5.7 个月)。估计的中位 DOR 为 8.7 个月。
在 263 名复发或难治性 cHL 患者中评估了安全性。98% 的患者接受了自体 HSCT。患者在批准的剂量计划中接受了中位数 10 剂纳武单抗(范围:1、48)。任何级别的最常见(至少 20%)不良反应是疲劳、上呼吸道感染、咳嗽、发热和腹泻。其他常见不良反应(报告至少 10%)包括皮疹、瘙痒、肌肉骨骼疼痛、恶心、呕吐、腹痛、头痛、周围神经病变、关节痛、呼吸困难、输液相关反应和甲状腺功能减退或甲状腺炎。
其他免疫介导的不良反应发生在 1% 至 5% 的患者中,包括皮疹、肺炎、肝炎、甲状腺功能亢进和结肠炎。21%的患者报告了严重的不良反应。最常见的 SAE(在 1% 至 3% 的患者中报告)是肺炎、胸腔积液、肺炎、发热、输液相关反应和皮疹。
针对纳武利尤单抗后异基因 HSCT 的并发症发布了新的“警告和注意事项”。已经发生了与移植相关的死亡,卫生保健专业人员应密切关注患者,以寻找移植相关并发症的早期证据,例如超急性移植物抗宿主病 (GVHD)、严重急性 GVHD、需要类固醇的发热综合征、肝静脉-闭塞性疾病和其他免疫介导的不良反应。FDA 已要求制造商在 nivolumab 后进一步研究同种异体 HSCT 的安全性。
纳武利尤单抗的推荐剂量方案为每 2 周静脉注射 3 mg/kg,直至疾病进展或出现不可接受的毒性。